
✅ GMP 데이터 완전성 개요:
ALCOA+ 원칙과 실무적 중요성
“데이터가 우연하게 또는 의도적으로 변경되거나
파괴되지 않도록 보존하고,
데이터의 특성이 데이터 전주기 동안 유지되어야 한다.”
(출처: 식약처, 「첨단바이오의약품 데이터 완전성 안내서」, 2023.1.30.)
1. 데이터 완전성(or무결성)이란?
- 데이터 완전성(Data Integrity, DI)이란 GMP 환경에서 생성·처리·보관되는 모든 데이터가
신뢰할 수 있고, 위변조되지 않았으며, 검증 가능한 상태로 보존되고 있음을 의미합니다.
이는 의약품 품질보증의 핵심으로, GMP 실사 시 가장 중점적으로 점검되는 항목 중 하나입니다.
→ 종이 기록이든 전자 기록이든 책임자·시점·내용·보존 여부가 명확히 입증되어야 합니다.

2. 왜 데이터 완전성이 중요한가?
- 의약품 출하, 시험 결과, 품질 검토는 모두 기록 기반으로 판단됩니다.
- 데이터 누락·수정·허위기재는 GMP 품질시스템 전체를 무력화할 수 있습니다.
- 식약처, FDA, EMA는 데이터 완전성 위반을 중대한 결함으로 간주하며,
→ 반복 위반 시 경고장, 수입중지, 행정처분으로 이어질 수 있습니다.
📌 데이터가 신뢰되지 않으면, 제품도 절대 신뢰받을 수 없습니다.

3. ALCOA+ 원칙: 글로벌 표준
🔹 ALCOA – 핵심 5대 원칙
| 원칙 | 의미 | 실무 적용 포인트 |
| A – Attributable | 작성자·시점 명확 | 서명, 이니셜, 작성 일시 반드시 기재 |
| L – Legible | 가독성 확보 | 선명하고 누구나 읽을 수 있게 작성 |
| C – Contemporaneous | 실시간 기록 | 작업 즉시 기록, 소급 작성 금지 |
| O – Original | 원본 유지 | 원본 보관 필수, 전자기록은 Audit Trail 구현 |
| A – Accurate | 정확성 확보 | 사실에 근거, 데이터 조작 금지 |

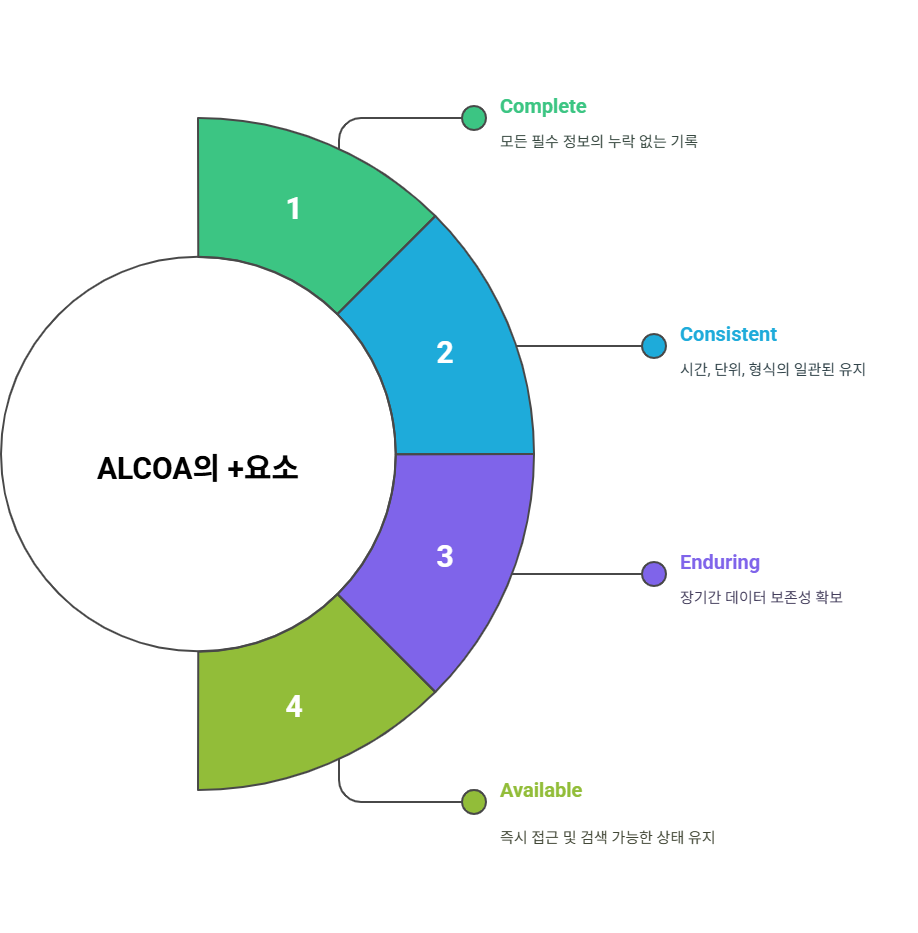
🔹 + 확장 4대 원칙 (ALCOA+)
| 원칙 | 의미 | 실무 적용 예시 |
| + Complete | 정보 누락 없음 | 모든 시험항목 기록, 공란 금지 |
| + Consistent | 일관성 유지 | 기록 양식과 작성 방식 표준화 |
| + Enduring | 장기 보존성 | 모든 기록의 보존체계 확립 |
| + Available | 접근 가능성 | 필요 시 즉시 검색·확인 가능한 체계 |
🔹 ALCOA++ 확장 요소 (EMA 제안 기준)
| 추가 원칙 | 의미 | 비고 |
| Traceable | 추적 가능성 | Audit Trail, 사용자 기록 관리 |
| Transparent | 투명성 | 변경 이력과 승인자 명확화 |
🔹 ALCOA → ALCOA+ → ALCOA++ 진화 흐름 구조도

| 단계 | 원칙 구성 | 적용 출처 |
| ALCOA | Attributable, Legible, Contemporaneous, Original, Accurate | FDA, PIC/S, WHO 기준 |
| ALCOA+ | + Complete, Consistent, Enduring, Available | PIC/S PI041, MFDS |
| ALCOA++ | + Traceable, Transparent | EMA 가이드라인 제안 |
4. ALCOA+ 적용 예시
✍️ 기록 예시: "2025.04.10 10:00 / 세척 완료 / 김품질"
| 평가 항목 | 충족 여부 | 실무 해설 |
| A – 작성자·시점 | ✅ | "김품질", "10:00" 명확히 기재됨 |
| C – 실시간 기록 | ✅ | 작업 직후 기록, 소급 작성 아님 |
| O – 원본 유지 | ✅ | 종이 또는 승인된 전자기록 원본 보존 |
| + Consistent | ✅ | 서식, 기재 방식, 단위가 일관성 있음 |
| + Available | ✅ | 지정된 장소에서 즉시 검토 가능 |
5. 주요 위반 사례와 품질 리스크
| 위반 사례 | 위반 항목 | 품질 영향 |
| 시험 후 2일 뒤 일괄 기록 | C – 동시성 위반 | 결과 조작 의심 및 로그 재현 불가능 |
| 서명 없는 중복 수정 | A, O – 귀속성·원본성 위배 | 책임자 불명확, 실사 시 CAPA 요구됨 |
| 작업자 대리 서명 | A – Attributable 위배 | 조작 의심 및 문서 무효화 가능성 |
| 로그북 기록 누락 및 공란 | + Complete 위배 | 허위 기록 의심 대상이 될 수 있음 |
| 원본 폐기 후 PDF 스캔본만 보관 | O, E – 원본성·보존성 위배 | 문서 무결성 손상 및 실사 부적합 가능성 |
6. 적용 대상 및 관리 범위
데이터 완전성은 GMP 전영역에 적용됩니다.
| 영역 | 적용 대상 예시 | 관리 요건 |
| 종이 기록 | 제조기록서, 시험기록서, 로그북 등 | 서명, 보존기간, 수정이력 관리 |
| 전자 기록 | ERP, eQMS, LIMS, MES 등 | CSV, Audit Trail 필수 구현 |
| 환경/운영 정보 | 온도/압력 기록, CCTV 영상 등 | 실시간 기록 및 보존체계 구축 |
| 하이브리드 시스템 | 종이기록과 전자승인 혼합형 시스템 | 이중 기록 방지, 데이터 동일성 보장 |
📌 전자기록은 반드시 Audit Trail 기능이 포함되어야 하며,
해당 시스템은 CSV(Computer System Validation)를 통해 검증되어야 합니다.

📚 주요 용어 정리
| 용어 | 정의 | 비고 |
| ALCOA+ | 국제 데이터 완전성 원칙 (9개 항목) | 실사 필수 점검 항목 |
| ALCOA++ | EMA 확장 기준 (추적성·투명성 포함) | 전자시스템 강화 기준 |
| Audit Trail | 전자기록의 변경·접근 이력을 자동으로 기록하는 기능 | CSV 완료 시스템만 해당 |
| CSV | 전산시스템 신뢰성 검증 프로세스 | 21 CFR Part 11, EU Annex 11 기반 |
| GDocP | Good Documentation Practice (우수 문서관리 기준) | 기록의 정확성·책임성·일관성 기반 체계 |
| 실시간 기록 | 작업 수행 시점에 즉시 작성하는 기록 | Contemporaneous 원칙 적용 |
📕 참고문헌
- 식품의약품안전처, 「첨단바이오의약품 데이터 완전성 안내서」, 민원인 안내서, 2023.1.30
- PIC/S, Good Practices for Data Management and Integrity in regulated GMP/GDP Environments, PI 041-1, July 2021
- FDA, Data Integrity and Compliance with Drug CGMP – Q&A Guidance for Industry, December 2018
- WHO, Technical Report Series No. 1033, Annex 4: Guideline on Data Integrity, Fifty-fifth report
- EMA, Guideline on computerised systems and electronic data in clinical trials, Draft, June 2021
🔗 관련 포스팅 링크
'GMP 기초 > GMP 문서, 규정, 시스템 이해하기' 카테고리의 다른 글
| GMP QMS의 기본 개념: 품질경영시스템과 핵심 구성 요소 (0) | 2025.05.16 |
|---|---|
| GMP 변경관리와 일탈관리: 품질 시스템의 핵심 구분 (0) | 2025.05.14 |
| GMP 밸리데이션: 품질 일관성과 신뢰성 확보의 과학적 기반 (0) | 2025.05.14 |
| GMP 문서화와 기록관리: SOP, 기록서, 로그북의 정확한 이해 (0) | 2025.05.13 |
| GMP 법령과 가이던스 체계: 고시, 안내서, 국제 기준까지 (0) | 2025.05.13 |



