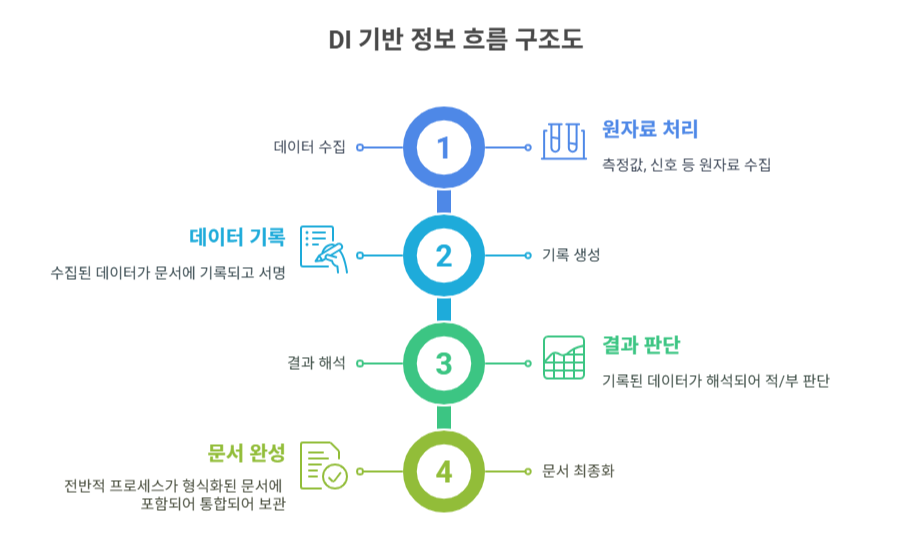
첨단의약품이란 무엇인가 – 품질심사의 기준을 다시 묻다 – ⚠️ 본 포스팅은 발표자료를 기반으로 요약·해석한 내용으로, 보다 정확한 판단을 위해서는 원문 자료를 참고해야 합니다. 🔹서론첨단의약품 품질 평가의 필요성:첨단의약품의 품질은 어떻게 평가해야 할까요? 기존의 저분자 의약품 중심 심사 방식으로는 새로운 약물 유형을 평가하는 데 한계가 있습니다.이에 식품의약품안전처는 2025년 정책설명회를 통해 첨단의약품 품질심사의 새로운 방향을 제시하였습니다.본 포스팅의 내용:이 포스팅에서는 첨단의약품의 개념과 구조적 특성, 그리고 이에 따른 평가 체계의 변화 필요성을 살펴보겠습니다."첨단의약품은 단일 구조의 저분자 의약품과 달리 복합구조이며, 분석 기술로 완전한 특성 규명이 불가능한 경우가 많아, 시험방법의 ..