✅ GMP QMS의 기본 개념:
품질경영시스템과 핵심 구성 요소
"QMS는 단순한 관리가 아니라, 환자에게 안전하고 일관된 품질의
의약품을 제공하기 위한 품질 철학의 실현 수단입니다."
(출처: ICH Q10, PIC/S PE009-17 Ch.1, MFDS GMP 고시 제2024-87호, GMP 가이던스 개정판)
1. QMS란 무엇인가?
- QMS(Quality Management System)는 의약품의 품질을 지속적으로 보증하기 위해
조직의 책임, 정책, 절차, 인력, 자원, 품질활동을 통합한 시스템입니다.
GMP가 "무엇을 해야 하는가"를 규정한다면,
QMS는 "그것을 어떻게 실행하고 개선할 것인가"를 정의합니다.
📌 QMS는 단순한 문서관리 체계가 아닌,
환자 중심의 품질 목표 달성을 위한 전사적 품질경영 프레임워크입니다.

2. QMS의 목적과 중요성
목표: 환자에게 안전하고 일관된 품질의 의약품을 제공하는 것입니다.
이를 위해 QMS는 다음을 보장해야 합니다:
- GMP 규정의 일관된 실행
- 문서 및 데이터의 신뢰성과 추적성
- 문제 발생 시 효과적인 원인 규명과 개선(CAPA)
- 조직 전반의 품질문화와 지속적 개선 체계 구축

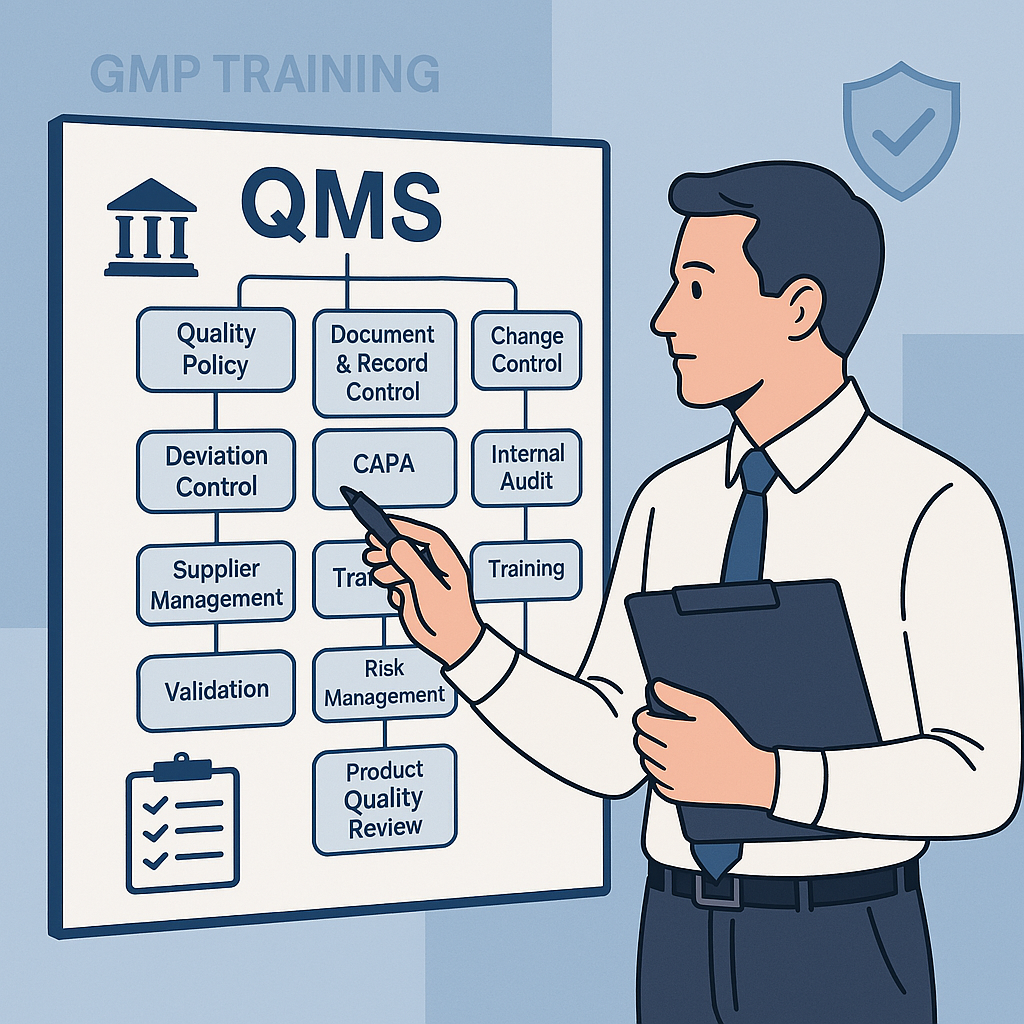
3. QMS 구성 요소: 12개 핵심 항목
QMS는 ICH Q10 및 PIC/S PE009 기준에 따라 다음과 같이 운영됩니다.

| 분류(PDCA) | 항목 | 핵심 기능 |
| Plan | ① 품질방침 및 목표 | 조직의 품질 방향과 기준 설정 |
| ⑦ 공급자관리 | 외부 품질 요인 평가 및 관리 | |
| Do | ② 문서·기록관리 | 업무 표준화와 실행 추적 |
| ⑧ 교육훈련 | 품질역량 확보와 유지 | |
| ⑨ 밸리데이션 | 설비·공정·시험법의 적격성 입증 | |
| Check | ⑥ 자율점검 | 내부 품질시스템 점검과 사전 예방 활동 |
| ⑪ 제품 품질평가(PQR) | 배치별 품질경향 분석과 개선활동 도출 | |
| Act | ③ 변경관리 | 변경사항의 사전 평가와 승인 |
| ④ 일탈관리 | 기준 이탈의 대응과 문서화 | |
| ⑤ CAPA | 시정·예방조치의 관리와 효과성 평가 | |
| ⑩ 품질위험관리 | 리스크 기반 의사결정 지원 | |
| ⑫ 품질문화 정착 | 자율적 품질관리 문화 구축 |
4. QMS와 GMP의 연계 구조
📌 QMS는 GMP 실무 실행의 기반 시스템입니다.
| GMP 요구사항 | QMS 실행 방식 |
| 일탈 보고 의무 | 일탈보고서 양식, 원인 분석 절차, CAPA 연계 운영 |
| 변경 사전 통제 | 변경 요청 → 영향평가 → QA 승인 → 밸리데이션 연계 |
| 정기 교육 이행 | 교육 이수 이력관리, 효과성 평가 시스템 운영 |
| 문서 최신성 및 추적성 확보 | SOP 버전관리, 변경이력 확인 체계 운영 |
5. 규제기관의 QMS 실사 포인트
📌 단순한 "문서 보유 여부"가 아니라,
"문서와 실행 간의 정합성, 시스템 간 연계, 개선 결과의 효과성"을 중점 평가합니다.
| 평가 항목 | 실사 핵심 내용 |
| 문서관리 | SOP 체계, 변경관리 기록, 개정이력의 명확성 |
| 실무 일치성 | 작업현장과 기록 간 내용 일치 여부 |
| 시스템 연계성 | 변경관리 ↔ 일탈 ↔ CAPA 간 프로세스 통합 여부 |
| 개선 효과성 | CAPA 이행 후 재발 방지 여부, 교육/문서 반영 여부 확인 |
📎 예시: 실사 중 CAPA 이행 완료 후 효과검토가 누락되면 "형식적 대응"으로 간주될 수 있습니다.
6. 품질문화(Quality Culture)란?
품질문화란 조직 구성원 전체가 품질에 대한 책임을 인식하고, 자발적으로 품질을 우선시하는 조직적 태도를 의미합니다.
- 단순히 "지시를 따르는" 수준이 아닌,
- 현장 작업자가 이탈을 보고하고, QA가 이를 수용·시정할 수 있는 열린 구조가 필요합니다.
📌 실사에서는 "조직이 품질을 중심으로 운영되는가"를 평가하며,
이는 "경영진의 품질 의지"와 "현장의 품질 민감도"까지 포함합니다.
7. 관련 국제 기준
| 기준 | 설명 |
| ICH Q10 | 제약 품질경영시스템의 국제 표준으로, 품질수명주기 중심의 구조를 제시 |
| PIC/S PE009 | Ch.1에서 QMS의 목적과 요소를 명확히 규정하고, GMP 전반의 연계 구조를 제공 |
| MFDS GMP 고시 | ICH/PIC/S 기준을 반영한 국내 규정으로, 변경관리·문서관리·자율점검을 포함 |
| MFDS 민원인 안내서 | 변경관리, 품질보증, 자율점검, 교육 등 각 QMS 항목별 세부 가이드를 제공 |
📚 주요 용어 정리
| 용어 | 정의 | 실무 적용 예시 |
| QMS | 품질경영시스템 | GMP 시스템의 기반 구조 |
| 변경관리 | Change Control | 사전 영향평가와 승인 문서화 필수 |
| 일탈관리 | Deviation Management | 기준 미준수에 대한 보고·조사·조치 체계 |
| CAPA | Corrective & Preventive Action | 반복 방지를 위한 근본 원인 분석 및 개선 |
| 자율점검 | Self Inspection | 연간 계획에 기반한 내부 감사 및 시정조치 수행 |
| 품질문화 | Quality Culture | 품질을 '자발적 우선순위'로 인식하는 조직 태도 |
📕 참고문헌
- ICH Q10: Pharmaceutical Quality System, ICH Harmonised Tripartite Guideline
- PIC/S PE009-17 (2022), Guide to GMP for Medicinal Products, Part I, Chapter 1
- 식품의약품안전처, 「의약품 제조 및 품질관리기준」 고시 제2024-87호 (2024.12.30 일부개정)
- 식품의약품안전처, 「완제의약품 제조 및 품질관리기준 가이던스」 개정판 (2023)
🔗 관련 포스팅 링크
'GMP 기초 > GMP 문서, 규정, 시스템 이해하기' 카테고리의 다른 글
| GMP 데이터 완전성 개요: ALCOA+ 원칙과 실무적 중요성 (0) | 2025.05.14 |
|---|---|
| GMP 변경관리와 일탈관리: 품질 시스템의 핵심 구분 (0) | 2025.05.14 |
| GMP 밸리데이션: 품질 일관성과 신뢰성 확보의 과학적 기반 (0) | 2025.05.14 |
| GMP 문서화와 기록관리: SOP, 기록서, 로그북의 정확한 이해 (0) | 2025.05.13 |
| GMP 법령과 가이던스 체계: 고시, 안내서, 국제 기준까지 (0) | 2025.05.13 |



