
✅ 자율점검 교육: 품질경영의 핵심 요소
자율점검은 조직의 품질시스템을 지속적으로 향상시키기 위한
체계적인 사전 평가 프로세스입니다.
1. 자율점검이란 무엇입니까?
자율점검(Self-Inspection)은 품질관리의 핵심 요소로서,
GMP 기준에 의거하여 조직이 자체적으로 수행하는 체계적인 품질시스템 평가 프로세스입니다.
본 활동은 규제기관 실사나 고객 감사와 구별되며, 전문적이고 객관적인 내부 품질보증 프로그램으로서 운영됩니다.

📌 PIC/S PE009 Chapter 9 및 식약처 GMP 고시의 규정에 따라,
모든 제조소는 최소 연 1회 이상의 정기적인 자율점검을 이행해야 합니다.
2. 자율점검의 전략적 목표 및 기대효과
| 전략적 목표 | 세부 내용 |
| 운영 적합성 평가 | 표준운영절차(SOP) 준수 여부에 대한 체계적 검토 |
| 선제적 품질관리 | 실사 이전 잠재적 문제점 식별 및 개선 조치 |
| 품질시스템 고도화 | 주요 이슈의 근본 원인 분석을 통한 CAPA 체계 구축 |
| 역량 강화 기회 | 구성원의 SOP 이해도 및 품질 관리 역량 향상 |
📌 자율점검은 단순 점검 절차를 넘어선 포괄적 품질 평가 활동으로서,
문서 심사, 기록 검토, 현장 실사, 인터뷰 등을 통한 전반적 운영 실태 평가를 수행합니다.

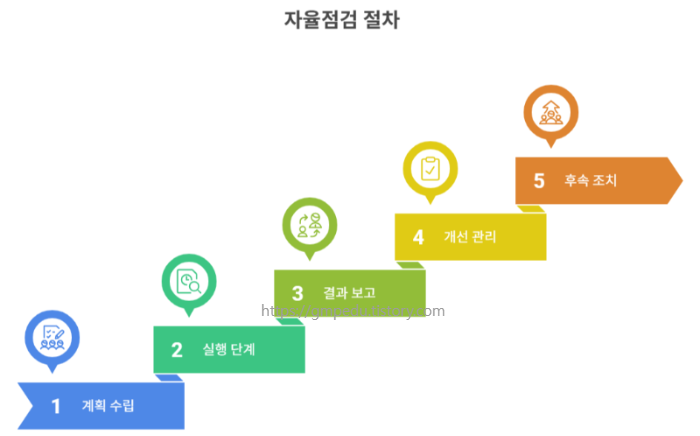
3. 자율점검의 절차는 어떻게 구성됩니까?
| 프로세스 | 주요 실행 사항 |
| ① 계획 수립 | 대상 영역 식별 및 점검 일정과 담당자 지정 |
| ② 실행 단계 | 현장 실사, 문서 심사, 이력 검토 및 관계자 면담 실시 |
| ③ 결과 보고 | 점검 내용 문서화, 개선사항 도출 및 권고안 제시 |
| ④ 개선 관리 | 시정조치 계획(CAPA) 수립 및 이행성과 모니터링 |
| ⑤ 후속 조치 | 결과 공유회 개최, 문서 관리체계 확립 및 차기 점검 설계 |
📌 모든 점검 활동은 상세한 문서화가 필수적이며,
발견사항에 대해서는 체계적인 CAPA 프로세스를 통한 관리가 요구됩니다.
4. 자율점검 vs 위탁사 Audit vs 규제기관 실사

| 구분 | 자율점검 | 위탁사 Audit | 규제기관 실사 |
| 평가 주체 | 내부 품질보증팀 또는 지정 평가자 | 위탁사 품질관리 전문가 | 관련 규제기관 |
| 주요 목표 | 품질시스템 최적화 | 협력사 품질역량 검증 | 규제 적합성 확인 |
| 실시 주기 | 연간 정기 평가 | 계약 단계별 필수 평가 | 정기 및 수시 점검 |
| 평가 특성 | 개선 및 역량 강화 중심 | 협력관계 검증 중심 | 규제 준수성 검증 |
| 문서화 | 평가보고서 및 개선계획 | 평가서 및 계약 검토 | 공식 실사 기록 |
📌 위탁사 Audit는 협력 관계의 지속성 판단 기준이 되며,
규제기관 실사는 인허가 및 운영 자격 유지를 결정합니다.
자율점검은 품질시스템을 체계적으로 발전시킬 수 있는 전략적 기회입니다.
5. 실무자가 자율점검 시 주의해야 할 사항

- 점검 체크리스트는 표준운영절차(SOP)에 기반한 체계적인 평가 지표로 구성되어야 합니다.
- 점검자 선정 시에는 해당 분야의 전문성을 갖춘 품질보증 담당자 또는 관련 부서 간 교차점검 인력을 배치하는 것을 권장합니다.
- 관찰된 부적합 사항은 객관적이고 명확한 근거를 바탕으로 기술하며, 개선 조치의 이행 기한 및 담당자를 구체적으로 명시해야 합니다.
- 점검 결과에 따른 교육 프로그램을 필수적으로 실시하고, 품질시스템의 지속적 개선을 위한 체계적인 접근을 추진해야 합니다.
📕 주요 용어 정리
| 용어 | 정의 |
| 자율점검(Self-Inspection) | 품질경영시스템의 적합성 평가를 위한 내부 품질관리 활동으로, GMP 규정에 따라 연 1회 이상 수행이 요구됨 |
| 고객 감사(Client Audit) | 위탁사/수입사가 제조소의 품질관리체계 적격성을 평가하는 공식 심사 절차 |
| 규제기관 실사 | 식약처, FDA 등 관할 규제기관이 실시하는 GMP 적합성 실태조사 |
| 점검보고서 | 평가 결과, 개선필요사항, 시정조치계획이 상세히 기술된 공식 품질문서 |
| CAPA | 시정조치 및 예방조치 - 품질개선을 위한 체계적 후속관리 프로세스 |
📚 참고자료
- PIC/S PE009-17 Chapter 9: Self Inspection
- 식약처 민원인 안내서: 자율점검편
- 식약처 GMP 고시 및 실사 대응 가이드
- WHO TRS 996 Annex 3
- FDA Inspection Manual
'GMP 기초 > 심화 이해와 실무 적용' 카테고리의 다른 글
| PIC/S란 무엇인가: 글로벌 GMP 기준의 중심 (0) | 2025.05.17 |
|---|---|
| GMP vs ISO 기준 차이: 구조, 목적, 실무 적용의 모든 것 (0) | 2025.05.17 |
| 자주 하는 GMP 오해와 진실: 대표 오해 팩트체크 (0) | 2025.05.17 |
| GMP 실무 핵심 용어 정리: 개념, 구분, 오용 방지까지 (0) | 2025.05.17 |
| GMP에 강한 회사의 특징 (0) | 2025.04.16 |



