
Annex 15 밸리데이션 실무 해설
– 적용 원칙과 검증 전략 –
공정·설비·분석법 밸리데이션 요건과
위험 기반 밸리데이션(RBV) 접근방법 총정리
1️⃣ 서론 – Annex 15의 밸리데이션 기준
Annex 15는 PIC/S 및 EU GMP에서
제정한 밸리데이션 활동의 표준 가이드라인입니다.
이는 공정, 설비, 시험법, 세척, 운송 등 품질 관련 모든 영역에서
설계 기반 검증과 체계적 문서화를 요구합니다.
📌 이 가이드라인은 ICH Q8~Q10 및 Q9 품질위험관리(QRM) 원칙과의
정합성을 바탕으로, 위험 기반 밸리데이션(RBV)을 핵심 전략으로 채택하고 있습니다.
출처: PIC/S PE009-17, Annex 15 (2015)
2️⃣ Annex 15의 밸리데이션 적용 범위
| 밸리데이션 대상 | 검증 목적 및 핵심 요건 |
| 공정 밸리데이션 | 제조 공정의 일관성과 품질 적합성 입증 |
| 설비 및 유틸리티 | 제조·포장 설비, HVAC, WFI의 적격성 평가 |
| 분석법 밸리데이션 | 시험 방법의 재현성, 정확성, 정밀성 입증 |
| 세척 밸리데이션 | 잔류물과 교차오염 제거의 효과성 입증 |
| 운송/보관 밸리데이션 | 온도, 습도 등 품질 유지 환경 조건 검증 |
| 재밸리데이션 | 변경관리와 주기적 검토에 따른 재검증 |
📊 밸리데이션 대상별 적용 영역

3️⃣ Risk-based Validation 방법론
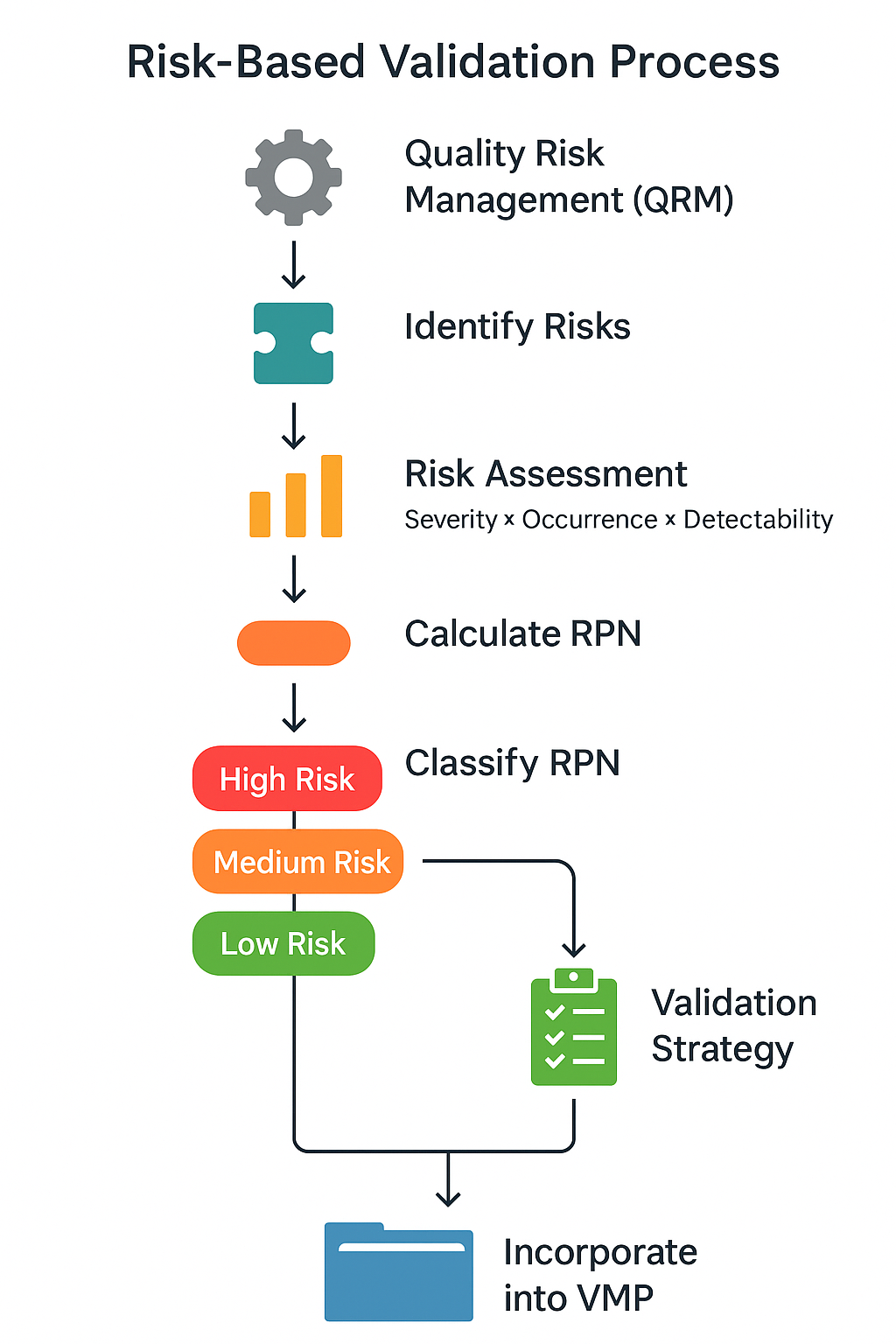
위험 기반 밸리데이션(RBV)은 ICH Q9 QRM 원칙을 실무에 적용한 방식입니다.
고위험 항목에 리소스를 집중하고 저위험 항목은 간소화하여 효율성과 품질 신뢰성을 동시에 확보합니다.
🔹 핵심 절차
- 위험도 평가(RPN): 심각도 × 발생빈도 × 검출난이도
- 단계별 접근: 고위험 → IQ/OQ/PQ 전면 적용 / 저위험 → 부분 평가
- VMP와 연계: 위험 분석 결과를 Validation Master Plan에 반영
🔹 적용 사례
| 설비 구분 | 검증 전략 |
| A 설비 | IQ, OQ, PQ 전체 수행 + 정기 유지보수 검증 문서화 |
| B 설비 | IQ/OQ 수행, PQ는 위험도(RPN) 평가 후 유연 적용 |
📊 위험 기반 밸리데이션 절차 흐름도
4️⃣ CPV와 FDA 기준 정합성
- 지속적 공정 검증(CPV)은 PQ 이후의 후속 단계로서, 실제 생산에서
통계적 공정 모니터링을 통해 품질 안정성을 지속적으로 입증합니다.
📌 FDA의 Process Validation (2011) 기준은 공정 검증을 3단계로 정의하며,
CPV는 세 번째 단계로 다음과 같은 특성이 있습니다:
- 품질 이상 감지(Deviation Signal Detection)
- 공정 편차 분석 및 시정조치 반영
- 검증 데이터의 지속적 기록 및 검토
5️⃣ MFDS vs PIC/S 기준 비교
| 항목 | PIC/S Annex 15 | 식약처 GMP 고시 |
| Validation 범위 | 설계→운전→모니터링을 포함한 통합적 접근 | 공정 밸리데이션 중심 |
| 위험 기반 적용 | QRM 기반 RBV 필수 | 원칙 수준만 명시, 상세 요구사항 없음 |
| VMP | 필수 전략 문서, QRM 결과 통합 | 자율 문서, 공식 요건 없음 |
| 재밸리데이션 | 변경관리와 주기적 재검토 모두 적용 | 변경 시 재검증 중심, 주기적 재검토 미언급 |
| 문서 이력 관리 | 실시간 문서화 및 이력 추적 필수 | 기본 보관 기준만 제시 |
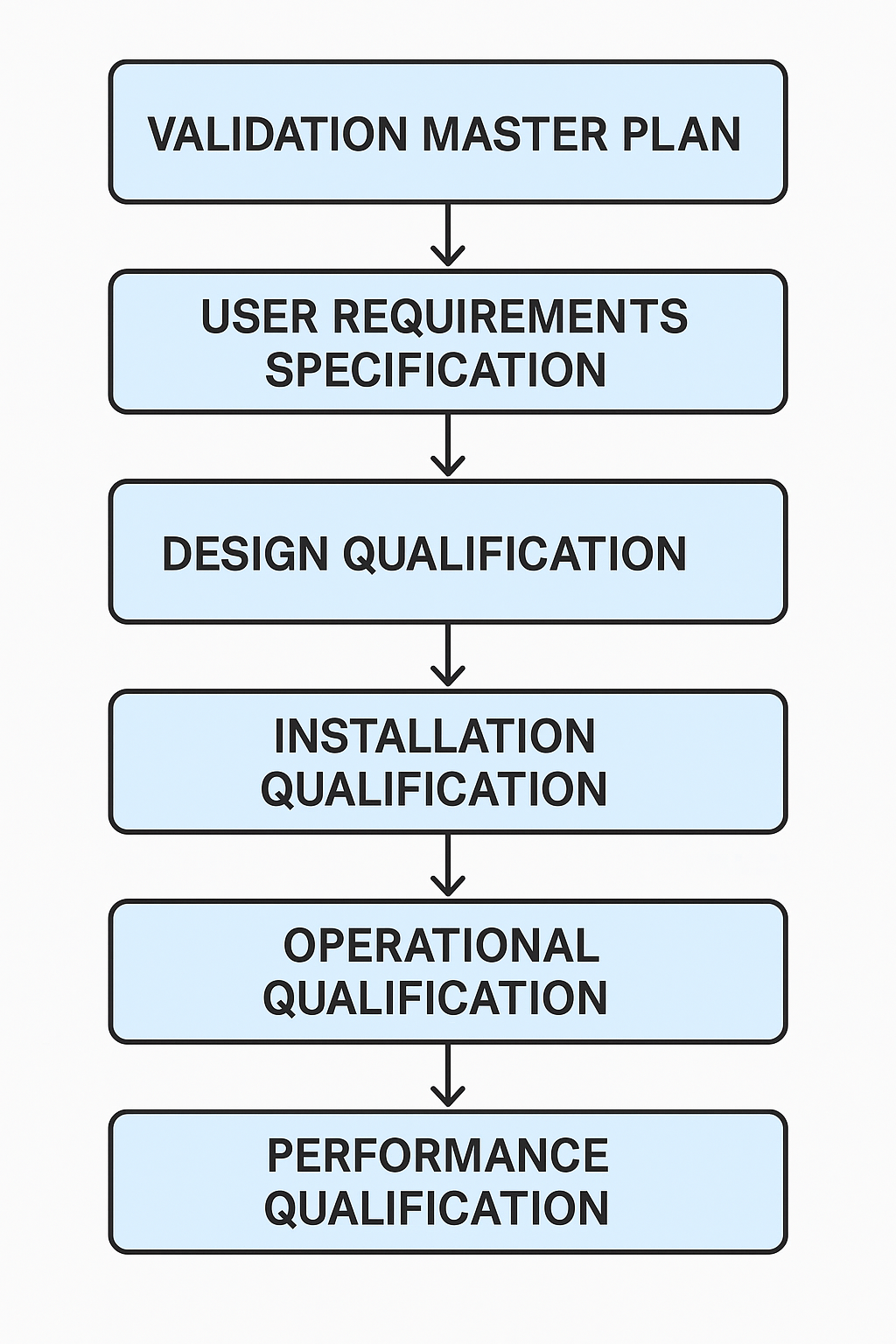
6️⃣ 밸리데이션 문서 흐름 체계
| 단계 | 정의 |
| VMP | Validation Master Plan – 전사적 전략 문서 |
| URS | User Requirement Specification – 사용자 요구사항 명세 |
| DQ | Design Qualification – 설계 적격성 평가 |
| IQ | Installation Qualification – 설치 적격성 평가 |
| OQ | Operational Qualification – 운전 적격성 평가 |
| PQ | Performance Qualification – 성능 적격성 평가 |
| CPV | Continued Process Verification – 지속적 공정 검증 |
📊 밸리데이션 문서 흐름도
7️⃣ 밸리데이션 실패 및 편차 발생 시 관리방안
- 실패 또는 일탈 발생 시 반드시 Deviation 문서화
- QA부서의 영향 평가 및 후속 조치 결정
- 필요 시 해당 단계 반복 수행 및 재검증
- Annex 15에 따라 비정상 결과 발생 시 과학적 근거 + 문서화 + 평가 이행 필수
8️⃣ 컴퓨터화 시스템 연계 (CSV 적용)
- Annex 15는 Annex 11(Computerized Systems)과 연동됨
- 특히 IQ/OQ 단계에서 CSV 요구사항 병행 적용 필요
- Audit trail, Access control 등은 Validation 범위에 포함되어야 함
9️⃣ 실무 대응 체크리스트
| 항목 | 확인 여부 |
| VMP 수립 및 승인 여부 | ☐ |
| 각 단계별 검증 문서 완비 | ☐ |
| 위험도 평가 결과 존재 및 적용 | ☐ |
| CPV 모니터링 시스템 구축 | ☐ |
| Deviation 문서 관리 체계 | ☐ |
| 컴퓨터화 설비의 CSV 적용 여부 | ☐ |
🔟 결론
밸리데이션은 단일 활동이 아닌 품질 시스템(QMS) 내 전략적 관리 프로세스입니다.
Annex 15는 과학적 데이터와 QRM 기반의 판단을 통해
검증의 신뢰성과 실효성을 동시에 보장하는 지침을 제공합니다.
- CPV는 실시간 모니터링을 통한 장기 품질 관리의 핵심 요소입니다
- VMP는 전체 검증 전략의 근간이 됩니다
- RBV는 자원의 효율적 활용과 위험 통제의 최적점을 제시합니다
📚 주요 용어 정리
| 용어 | 정의 | 비고 |
| URS | 사용자 요구사항 명세서 | 밸리데이션 시작 문서 |
| DQ/IQ/OQ/PQ | 설계/설치/운전/성능 적격성 평가 | 전형적 4단계 검증 |
| CPV | 지속적 공정 검증 | 실시간 품질 보증 |
| QRM | 품질위험관리 | ICH Q9 기준 |
| RPN | 위험도 우선순위 지수 | RBV 기준 산정 요소 |
| CSV | 컴퓨터화 시스템 검증 | Annex 11 관련 문서 포함 |
📕 참고문헌
- PIC/S PE009-17, Annex 15: Qualification and Validation (2015)
- FDA Guidance for Industry: Process Validation (2011)
- ICH Q8, Q9, Q10 Guidelines
- WHO TRS 1019, Annex 3
- PDA Technical Report No. 60: Process Validation – A Lifecycle Approach
- 식약처 고시 제2024-87호: 의약품 제조 및 품질관리기준
🔗 관련 포스팅 링크
반응형
'GMP 심화 > GMP 고시 및 국제 가이드 적용 전략' 카테고리의 다른 글
| 컴퓨터화 시스템 밸리데이션(CSV) 실무 적용법 (1) | 2025.05.24 |
|---|---|
| 무균의약품 GMP 핵심 가이드 (0) | 2025.05.23 |
| 비무균제제 GMP 이해 (1) | 2025.05.23 |
| 「의약품 제조 및 품질관리에 관한 규정」(2024-87호) 개정 해설 (0) | 2025.04.23 |