
글로벌 실사 대응 전략
– FDA 483과 EMA 지적 대응법 –
FDA 483과 EMA Deficiency Letter에 대한
실무적 이해와 효과적인 대응 전략을 체계적으로 정리하였습니다.
1️⃣ 글로벌 GMP 실사 개요
글로벌 규제기관(FDA, EMA)의 GMP 실사는
제품의 품질·안전·신뢰성을 확보하기 위해
국제 표준 기반의 품질 시스템 운영 여부를 평가하는 필수 절차입니다.
✅ 핵심 실사 목적
- 품질시스템의 설계·이행·유지관리 체계 점검
- 수출 허가 및 시장 신뢰성 유지 여부 평가
- GMP 인증 유지 및 허가 심사 연계
✅ 주요 문서 구분
| 문서명 | 정의 | 특성 |
| FDA Form 483 | FDA 실사 후 발행되는 관찰사항 통보서 | 15일 이내 서면 답변 필수 |
| EMA Deficiency Letter | EMA 또는 각국 기관의 실사 결과 문서 | 결함 등급에 따른 시정 기한 제시 |
📌 실사 결과에 대한 적절한 대응이 없을 경우, 경고장 발행, 수출 제한, 제조 중단 등의 제재가 따를 수 있습니다.
2️⃣ 규제기관별 실사 특성 및 지적사항 비교
| 항목 | FDA 483 | EMA Deficiency Letter |
| 발행 주체 | 미국 FDA | EMA 또는 유럽 내 국가 규제기관 |
| 발행 시점 | 실사 종료 직후 (On-site) | 심사 중 또는 종료 후 (문서심사 포함) |
| 문서 성격 | "관찰사항(Observation)"에 대한 통지 | 공식 행정 문서로 결함 등급 포함 |
| 대응 기한 | 15일 이내 공식 서면 회신 필수 | 통상 30일 이내 (기관별 상이) |
| 평가 중점 | 데이터 신뢰성, 시스템 적합성 중심 | QRM 기반 문서화 체계, 품질 보증 운영 적정성 중심 |
3️⃣ 공통 주요 지적사항 및 실무 대응 포인트
✅ 1. 데이터 무결성 or 완전성 (Data Integrity, DI)
- 감사추적(Audit trail) 미활성화 및 로그 삭제 가능 구조
- 관리자 계정 무단 공유 및 백업 정책 부재
- 대응: 사용자 권한 체계적 분리, 감사로그 정기 검토, 백업·복구 검증 문서화
✅ 2. 공정 밸리데이션 및 지속적 검증 (Process Validation & CPV)
- 밸리데이션 계획서 미흡 및 지속적 모니터링 계획 누락
- 대응: 지속적 공정검증(CPV) 포함된 밸리데이션 마스터플랜 수립, 통계적 관리 전략 구축
✅ 3. 환경모니터링 및 청정도 관리
- 기준치 초과 미생물 검출 후 후속조치 미흡
- 대응: 환경모니터링 결과에 대한 추적성 확보 및 시정조치 이력 관리
✅ 4. 문서 및 교육 체계
- 표준작업지침서(SOP)와 실제 작업 불일치, 교육 미이수자 관리 미흡
- 대응: SOP 버전 관리 체계화, 교육 이력 시스템 구축

4️⃣ 지적사항 대응 절차 및 문서 전략
✅ 대응 프로세스 (공통 절차)
🔸 지적 대응 프로세스 흐름도
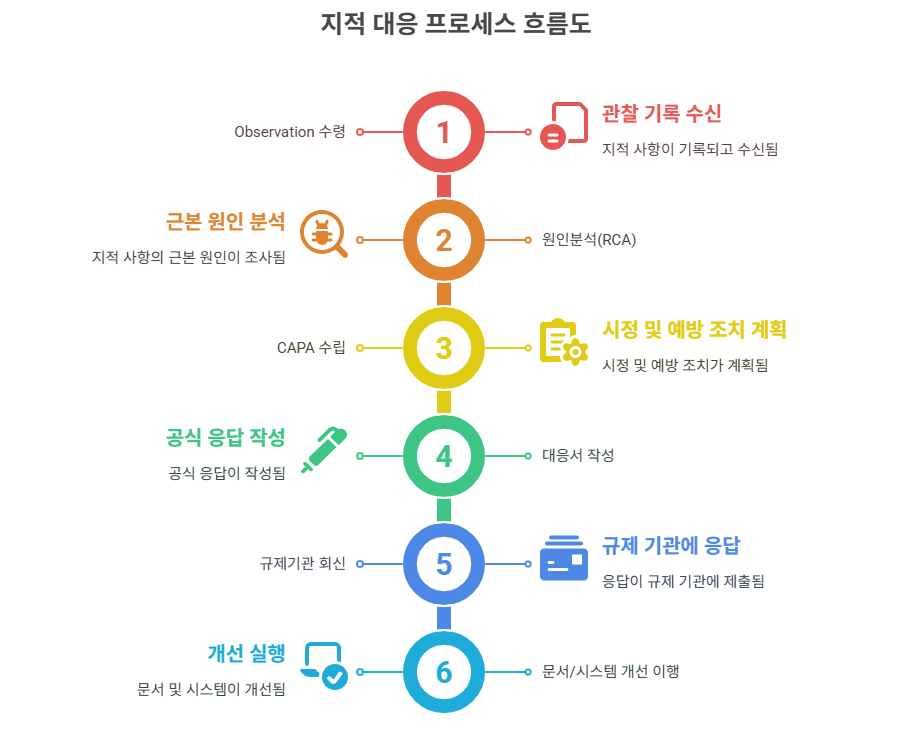
✅ 대응 문서 구조 (예시)
| 항목 | 내용 예시 |
| 문제 요약 | "데이터 무결성 위반 위험: 백업 체계 미흡" |
| 원인 분석 | 백업 정책 미수립 및 책임자 미지정 |
| 개선 조치 | 백업 정책 수립, 시스템 이중화 구현, 직원 교육 실시 |
| 입증 자료 | 변경관리 보고서, 개정된 SOP, 교육 이수 기록 |
근본 원인 분석 시 특성요인도(Fishbone Diagram) 및 5 Why 분석 기법 활용을 권장합니다.
5️⃣ 회신문서 작성 전략 – 규제기관별 접근 차이
| 항목 | FDA 회신 전략 | EMA 회신 전략 |
| 표현 방식 | 간결하고 명확한 문장, 숫자·사실 기반 중심 | 체계적 설명과 문서 흐름 강조 |
| 대응 기한 | 15일 이내 | 통상 30일 이내 (기관 요청 기준 따름) |
| 필수 포함 요소 | 문제 요약 / 원인 분석 / 개선 조치 / 입증 자료 | 지적 등급에 따른 단기/중기/장기 개선계획 병렬 제시 |
| 번역 문서 | 공인번역본(Certified Translation) 동시 제출 권장 | 원문 + 번역본 동시 제출, "추적용 문서번호" 기입 필수 |
6️⃣ 전략적 대응 요소 요약
| 핵심 요소 | 실무 전략 방향 |
| 품질 시스템 정합성 | SOP, QRM, CAPA, 교육 문서 간 연계 체계 강화 |
| 데이터 신뢰성 | DI 평가 도구 활용, Audit trail 정기 리뷰 프로세스 운영 |
| 문서 일관성 | 변경관리, 밸리데이션, 교육 등 전자문서관리(EDMS) 기반 일관성 유지 |
| 회신 품질 | 규제기관별 표현 방식, 대응 범위, 입증 자료 구성 기준 숙지 |
7️⃣ 결론 – 글로벌 규제기관 실사의 본질과 대응 전략
FDA 및 EMA의 GMP 실사는 단순 이슈 점검이 아닌,
글로벌 수준의 QMS 역량을 평가하는 공식 절차입니다.
- 성공적 대응을 위해선 사전부터:
- 문서 연계성, 위험기반 사고, 감사 준비도 점검
- 대응서 품질 관리 및 내부 시뮬레이션 브리핑 체계화
- 실사 이후에는:
- 지적 사항의 근본 원인(RCA) 기반 개선 전략
- 지속 가능한 시스템 강화 방안(CAPA + 교육 + SOP 통합)을 수립해야 합니다.
📌 글로벌 규제기관 실사는 품질문화(Quality Culture)의 성숙도 평가입니다.
📚 주요 용어 정리
용어 정의 실무 참고사항
| 용어 | 정의 | 실무 참고사항 |
| FDA 483 | 미국 FDA 실사 후 발행되는 관찰 통지서 | 15일 내 서면 회신 필요 |
| Deficiency Letter | EMA에서 발행하는 결함 지적 문서 | 결함 등급에 따라 개선 기한 차등 설정 |
| CAPA | 시정 및 예방조치 계획 | SOP 개정, 교육, 시스템 변경까지 포함 |
| CPV (Continued PV) | 공정의 지속 검증 단계 | PQ 이후 통계 기반 모니터링 체계 필요 |
| QRM | 품질위험관리 | ICH Q9 기준 문서화 요구 |
📕 참고문헌
- FDA Form 483: Inspectional Observations
- FDA Compliance Policy Guide Sec. 130.300
- EudraLex Vol.4 Chapter 1 (Pharmaceutical Quality System)
- EMA Compilation of Community Procedures
- ICH Q8(R2), Q9
- FDA Process Validation Guidance (2011)
🔗 관련 포스팅 링크
'GMP 심화 > GMP 실사 대응 고급 전략' 카테고리의 다른 글
| 반복 GMP 지적의 원인 분석과 품질 시스템 개선 전략 (0) | 2025.05.25 |
|---|---|
| 식품의약품안전처(MFDS) 실사 대응 문서 정리 전략 (0) | 2025.05.24 |

