
GMP 디지털 전환과 자동화 품질 시스템 전략
MES, LIMS, PAT, ERP, QMS, EDMS 통합 운영을 통한
데이터 무결성 확보와 CSV 기반 품질관리 체계 고도화
🔹 서론 – 디지털 기술은 GMP 품질문화의 실현 수단
- GMP의 디지털화 배경:
- 기존의 수작업 중심 품질관리 방식으로는
반복 오류, 기록 누락, 통합 관리의 어려움이 발생합니다. - 이러한 문제를 해결하기 위해
디지털 전환(Digital Transformation)과 자동화 시스템 도입이 필수적입니다.
- 기존의 수작업 중심 품질관리 방식으로는
- 디지털화의 핵심 가치:
- 데이터 기반 품질관리, 실시간 모니터링, 문서화의 일관성을 확보할 수 있습니다.
- 이를 통해 ALCOA+ 원칙을 준수하는 품질 신뢰성 달성이 가능합니다.
- 도입 시스템 개요:
- MES, LIMS, PAT, ERP, QMS, EDMS, AI, SCADA 시스템은
각각 고유한 기능을 수행합니다. - 이러한 시스템들의 통합 운영을 통해
품질 데이터의 무결성과 효율성을 확보할 수 있습니다.
- MES, LIMS, PAT, ERP, QMS, EDMS, AI, SCADA 시스템은
1️⃣ 주요 자동화 시스템과 GMP 연계 전략
🔸GMP 자동화 시스템 기능 비교표
| 시스템 | 주요 기능 | 데이터 무결성 기여 | CSV 필수 여부 |
| MES | 배치 흐름 관리, 작업 지시, 실시간 제조기록 |
전자서명, 감사추적, 작업표준화 |
✅ 필수 |
| LIMS | 시험 결과 기록, 시험 이력 관리 |
시험결과 일관성, 이력 추적성 확보 |
✅ 필수 |
| PAT | 공정 실시간 분석, 품질 예측 제어 |
공정변수 자동 제어, 실시간 감시 |
⭕ 조건부 (리스크 기반) |
| ERP | 자재, 배치, 자원관리 통합 | 배치번호, 자재정보의 정합성 유지 |
⭕ 시스템 간 연계 시 요구됨 |
| QMS | CAPA, 변경관리, 교육관리 자동화 |
조치 이력의 추적성 확보, 교육이행 기록 |
✅ 필수 |
| EDMS | SOP, 기록문서 관리 | 변경이력, 승인 이력, 원본성 보존 |
✅ 필수 |
| AI 시스템 | 이상 탐지, 예측분석 (예: OOS 예측) |
품질 편차 조기 식별 및 대응 자동화 |
⭕ 파일럿 사용 시에도 CSV 필요 |
✅ MES – 제조실행시스템
- 배치 기록과 작업흐름의 체계적 관리
- 전자서명 및 감사추적 기능 내장
- 도입 시 CSV 필수
✅ LIMS – 시험실 정보 관리 시스템
- 시험 기록과 분석이력의 통합 관리
- 시험 프로세스의 자동화 및 이력추적
- 전자 기록 기반 ALCOA+ 준수
✅ PAT – 공정 분석 기술
- 실시간 품질 파라미터 모니터링
- QbD 기반의 공정설계와 공정능력 향상
- 통계 기반 자동 제어 가능
✅ ERP – 전사적 자원관리
- 자재, 배치, 자산 데이터의 통합
- 제조·품질 시스템 간 데이터 정합성 보장
- QMS·MES와의 연계 중요
✅ QMS – 품질관리 시스템
- CAPA, 변경관리, 교육이력의 자동화
- 전자 SOP 관리와 교육 연동
- 시정조치 이행과 효과성 추적 필수
✅ EDMS – 전자문서관리시스템
- SOP, 기록서 등 전자기록의 통합 관리
- 감사이력과 버전 관리의 체계화
- 감사 대응 자료의 일관성 확보 수단
✅ AI 및 고도화 기술
- OOS/OOT 예측 알고리즘의 적용 가능
- 이상값 탐지와 품질 편차의 조기 식별
- Batch release 자동화 등의 활용 가능
2️⃣ 시스템 도입 시 데이터 무결성 충돌 사례
✅ 대표 충돌 유형과 리스크
| 유형 | 설명 |
| Hybrid 기록 | 전자/수기 기록 병행으로 인한 Audit Trail 누락 및 중복 기재 |
| Audit Trail 미비 | 기록 변경 이력 미기록으로 인한 검토 불가 및 조작 가능성 |
| CSV 미이행 | 시스템 검증 생략으로 인한 규정 불일치 및 부적합 |
| 타임스탬프 불일치 | 시스템 간 시간 동기화 실패로 인한 일자 불일치 지적 |
| 권한관리 오류 | 관리자 권한 과다 부여로 인한 무단 변경 및 삭제 리스크 |
| ERP-QMS 정보 불일치 | 승인된 자재변경(QMS)이 ERP에 미연동되어 기존 기준으로 제조 시 배치 기록 오류 발생 |
✅ 실사 지적 사례 예시
- LIMS 기록의 수기 재기재로 인한 불일치 지적
- MES와 ERP 간 배치 종료시간 불일치로 인한 데이터 정합성 문제
- QMS CAPA 완료일과 교육 이행일 불일치로 인한 효과성 검토 실패
🔸 주요 시스템 간 데이터 흐름도
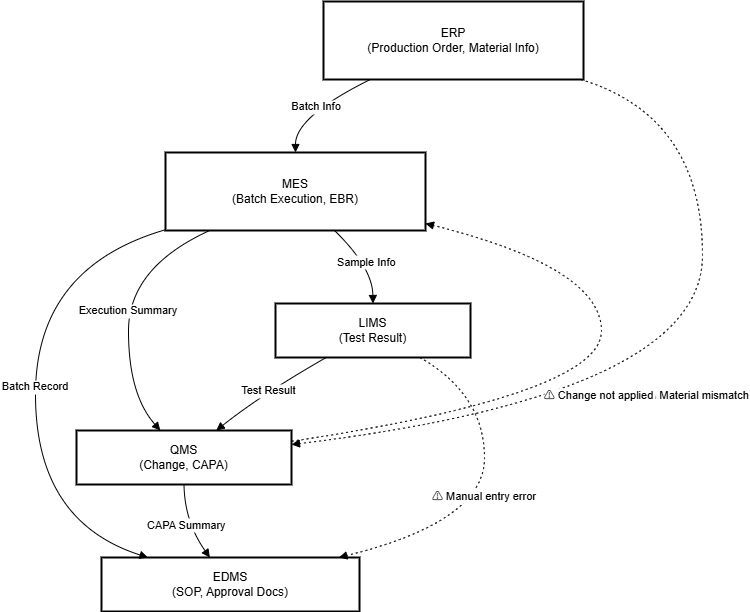
3️⃣ 자동화 시스템 도입 시 고려사항
✅ 기본 구축 요건
- CSV (컴퓨터화 시스템 밸리데이션) 수행: GAMP 5 기준 기반
- QRM 기반 시스템 평가: 영향도에 따른 리스크 분석
- 변경관리 체계 적용: 시스템 업그레이드나 설정 변경 시
- 접근권한 및 보안 설정: 관리자 권한 최소화 원칙 적용
- ALCOA+ 기준 충족 여부 검토: 실시간성, 판독성, 원본성 등
🔹 정리 – 디지털 자동화는 GMP 철학의 기술적 실현
- 기술은 도구, 책임은 인간에게:
- 디지털화는 GMP의 핵심 원칙(문서화, 추적성, 무결성)을
더 높은 수준에서 구현할 수 있는 수단입니다. - 하지만 시스템이 완전하다고 해서 사람의 책임이 면제되는 것은 아닙니다.
- 디지털화는 GMP의 핵심 원칙(문서화, 추적성, 무결성)을
- QA 조직의 역할:
- 기록 오류나 불일치 발생 시, QA 조직의 검토와 판단이 여전히 중심이 되어야 합니다.
- 통합 품질관리 전략:
- 디지털 시스템은 문서화, 교육, 점검과
유기적으로 연계된 통합 품질관리 전략으로 운영되어야 합니다.
- 디지털 시스템은 문서화, 교육, 점검과

📚 주요 용어 정리
| 용어 | 정의 | 설명 요약 |
| MES | 제조 실행 시스템 | 배치 흐름, 작업기록 실시간 추적 |
| LIMS | 시험실 정보 관리 시스템 | 시험 결과 통합, 이력 관리 |
| PAT | 공정 분석 기술 | 실시간 품질 감시 및 공정 제어 |
| ERP | 전사 자원관리 시스템 | 자재/배치/공정 정보 연동 |
| QMS | 품질 관리 시스템 | CAPA, 변경, 교육 자동화 |
| EDMS | 전자 문서 관리 시스템 | SOP, 기록문서 전주기 관리 |
| AI | 인공지능 기술 | 품질 이상 탐지 및 예측 |
| CSV | 컴퓨터화 시스템 밸리데이션 | 시스템 적합성 검증 절차 |
| Audit Trail | 감사추적 기능 | 변경이력 자동 기록 |
| ALCOA+ | 데이터 무결성 원칙 | Accurate, Legible, ... 등 |
📚 참고문헌
- PIC/S PI 041-1 (2021), Good Practices for Data Management and Integrity in Regulated GMP/GDP Environments
- WHO TRS 996 Annex 5, Good Data and Record Management Practices
- WHO TRS 1019 Annex 1
- 식약처, 「바이오의약품 제조업체 데이터완전성 지침 Q&A」
- 식약처, 「데이터 완전성 가이드라인」
- 식약처, 「의약품 제조 및 품질관리기준 가이던스」
🔗 관련 포스팅 링크
반응형
'GMP 심화 > 품질 데이터 기반 운영 & 트렌드' 카테고리의 다른 글
| GMP 인증 취득 전략과 감사 대응 매뉴얼화 (0) | 2025.05.26 |
|---|---|
| Data Integrity 통합관리체계 구축 전략 (0) | 2025.05.26 |
| GMP 품질 메트릭스 실무 전략 (0) | 2025.05.25 |