
✅ DI 위반 발생 시 효과적인 위기 대응 전략
– CAPA 작성부터 규제기관 소명까지 단계별 가이드 –
“DI 위반은 단순한 오류가 아닌, 시스템과 문화의 실패다.
이에 대한 대응은 기술과 조직의
신뢰를 회복하는 과정이어야 한다.”— PIC/S PI 041-1, 2021
🔹 서론 – DI 위반, 어떻게 대응할 것인가?
- 데이터 무결성(Data Integrity, 이하 DI) 위반은 GMP 시스템의
신뢰성을 근본적으로 훼손할 수 있는 중대한 문제입니다. - 최근 사례를 보면, 국내 A사는 시험기록 누락으로 시정명령을 받았고,
유럽의 B사는 전산 로그 조작으로 수출이 중단되었습니다. - DI 위반은 다음과 같이 유형별로 구분됩니다:
- 시스템 오류: 자동 감사기록 미생성, 로그 누락 등
- 조작: 시험 결과값 수기 변경, 전자기록 무단 수정
- 기록 누락: 시험 결과 미기입, 의도적 생략, 지연 등록
- 본 포스팅은 실무자들이 DI 위반 발생 시 즉각적 대응부터 CAPA 수립,
규제기관 소명까지 체계적이고 신뢰성 있게 처리할 수 있도록 설계되었습니다.
🔹 본론 – 단계별 DI 위반 대응 전략
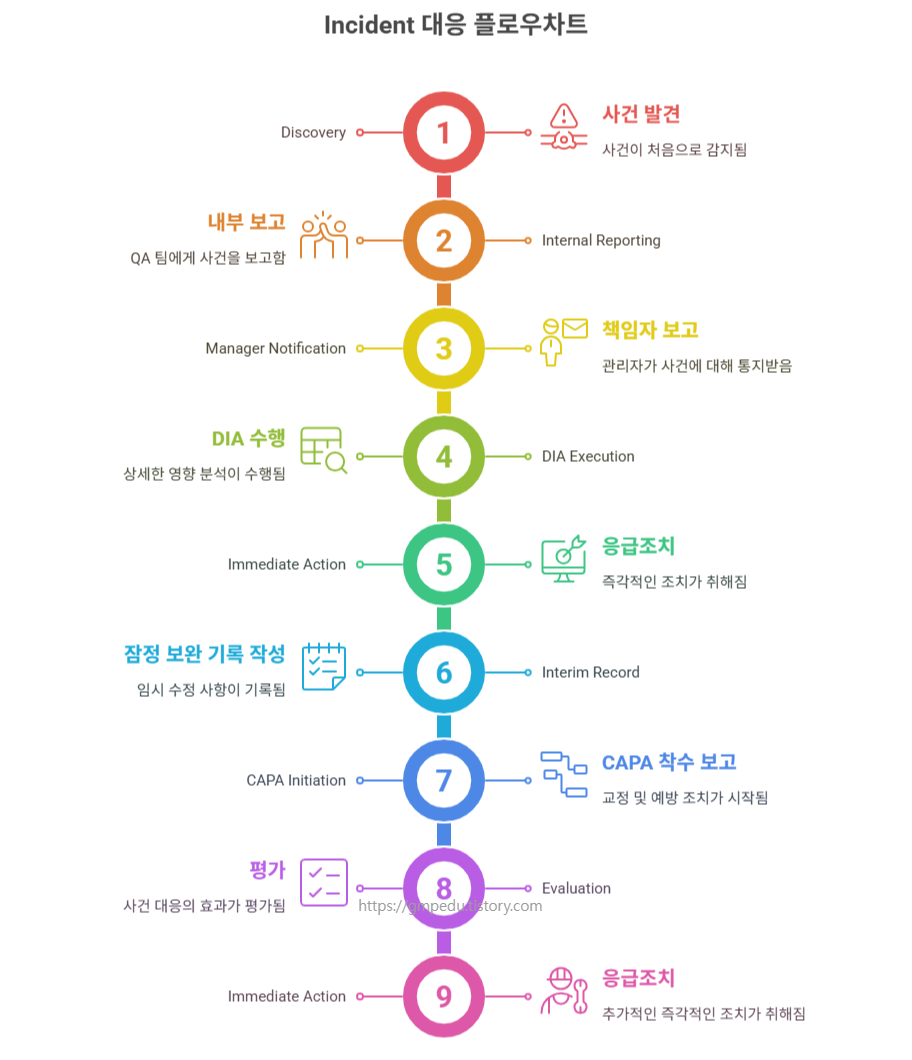
✅ 1단계: Incident 식별 및 초기 조치
- DI 위반 상황을 인지하면 즉시 다음 보고체계를 따릅니다:
- 현장 직원 → QA → 생산 책임자 → DI 책임자
- 즉시 Incident Report를 작성하며, 다음 항목을 포함합니다:
- 발생 일시, 위치, 작업자, 시스템 정보
- 위반 내용 요약, 최초 발견자, 응급 조치 내용 등
- DIA(Data Impact Assessment)를 수행하여 품질 및 환자 안전에 미치는 영향을 평가합니다.
평가 결과는 다음과 같이 구분됩니다:등급 영향 수준 예시 Low 품질·환자 안전 무관 테스트 기록 오기 Medium 일부 영향 가능 결과 수정 후 정정 기록 없음 High 직접적 영향 무단 기록 삭제, 허위 입력 등 - 응급 조치 및 기록 관리: 문제 작업 중단과 관련 배치 보류 조치와 함께,
Temporary Record Correction(잠정 보완기록)을 통해 응급 조치와
의사결정을 투명하게 문서화합니다.
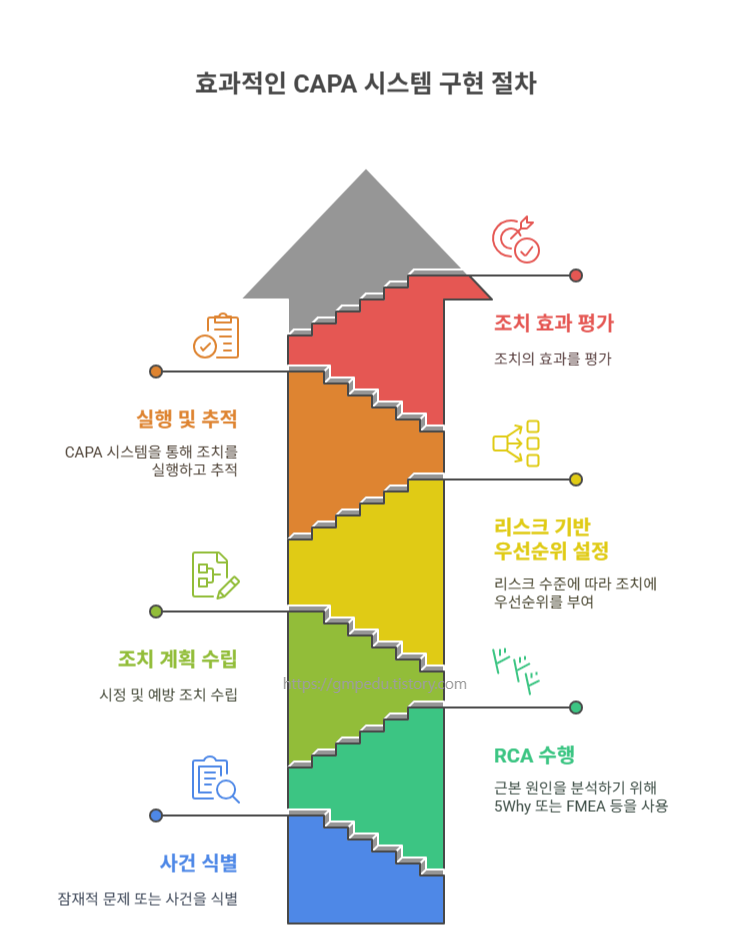
✅ 2단계: CAPA 수립 전략
- Root Cause Analysis (RCA)
- 유형별 적합한 RCA 기법:
기법 적용 사례 5-Why 단일 사건, 단일 작업자 실수 Fishbone Diagram 다부서 협업 오류 FMEA 반복 오류, 시스템적 결함 가능 시
- 유형별 적합한 RCA 기법:
- Corrective Action (CA)
- 단기적 조치 정의:
- 시스템 수정, 책임자 재교육, 작업 일시 중단 등
- 단기적 조치 정의:
- Preventive Action (PA)
- 재발 방지를 위한 시스템 개선:
- SOP 개정, 권한관리 재설정, 백업 로깅 자동화 등
- 재발 방지를 위한 시스템 개선:
- 우선순위 설정 기준
- 조치 항목은 리스크 등급별로 Critical > Major > Minor 순으로 분류하여 실행합니다.
- CAPA Tracking 시스템 운영
- CAPA의 실행 → 검토 → 완료 → 효과 검증(Verification of Effectiveness, VoE)까지의
전체 프로세스를 전산 시스템에서 체계적으로 관리합니다.
- CAPA의 실행 → 검토 → 완료 → 효과 검증(Verification of Effectiveness, VoE)까지의
✅ 3단계: 규제기관 대응 전략
- 국내 실사에서는 '시정명령 사전소명' 제도를 활용할 수 있으므로, 소명서 준비가 필수적입니다.
- 소명서는 다음과 같은 구성으로 작성합니다:
| 항목 | 설명 예시 | 근거 문서 |
| 사실(Fact) | 위반 내용 | Incident Report, 감사기록 |
| 원인(Cause) | RCA 결과 | Fishbone 분석표, 교육 미이행 확인 |
| 조치(Action) | CA/PA 계획 및 실행 | CAPA 실행 이력 |
| 효과(Effect) | VoE 결과 | 추적 점검표, 교육 수료 보고서 |
- 관련 기준별 필수 증빙 자료:
| 기준 | 증빙 유형 |
| PIC/S Annex 11 | 시스템 로그, 감사 기록, 접근제어 이력 |
| WHO TRS 996 | SOP 개정 이력, 교육일지, 역할/권한 표기 조직도 |

🔹 정리 – DI 위반 시 실무자가 반드시 기억해야 할 3가지
✅ 신속한 판단보다 신뢰 회복이 우선이다
✅ CAPA는 문서가 아니라 개선의 증거여야 한다
✅ 내부 보고와 규제 대응은 분리되지 않고 연결되어야 한다

⚠️ 이렇게 하면 위험하다! (실무 안티패턴)
- 여러 사용자가 공용 ID를 사용
- 시험을 재실행하고 최초 결과를 삭제
- 기록 누락 후, 승인 없이 수정한 경우
→ 위 세 가지는 모두 식약처 「의약품 제조 및 품질관리에 관한 규정」 [별표 9]의
위반 소지가 있으며, 점검 시 주요 지적 대상입니다.
📚 주요 용어 정리
| 용어 | 정의 |
| Incident | 품질 또는 GMP 기준 위반 사건 |
| CAPA | 시정 및 예방 조치 조합 시스템 |
| RCA (Root Cause Analysis) | 사건의 근본 원인을 찾는 분석법 |
| DIA (Data Impact Assessment) | 품질 및 안전성 영향 평가 |
| Temporary Record Correction | 응급상황 시 작성되는 보완 기록 |
| VoE (Verification of Effectiveness) | CAPA 이행 후 효과를 검증하는 절차 |
| Regulatory Response | 규제기관 대응 문서 및 소명서 |
📕 참고문헌
- PIC/S PI 041-1, Good Practices for Data Management and Integrity, 2021
- MHRA, GxP Data Integrity Guidance and Definitions, 2021
- WHO TRS 996 Annex 5, Data Integrity in Regulated Laboratories, 2021
- 식품의약품안전처, 의약품 제조 및 품질관리에 관한 규정, 고시 제2024-87호, 별표 9
- 식약처, 데이터 완전성 평가지침, 2023
- ISPE, GAMP 5: A Risk-Based Approach to GxP Systems, 2008
🔗 관련 포스팅 링크
'데이터 무결성(Data Integrity, DI) > DI 심화' 카테고리의 다른 글
| 정성적 위험 평가와 조직 중심 DI 대응 전략 (0) | 2025.05.19 |
|---|---|
| DI 위반 리스크를 줄이기 위한 QRM 연계 전략 (0) | 2025.05.18 |
| AI 기반 시스템에서의 DI 실현 전략 (1) | 2025.05.16 |
| CSV 단계별 데이터 무결성 적용 가이드 (0) | 2025.05.15 |
| SOP, 교육, 점검의 DI 통합 운영 전략 (0) | 2025.05.14 |